rumus kimia dasar sma

Halo netizen semoga kalian sedang mantap, Sekarang ini ane mau membagikan informasi tentang rumus kimia dasar sma lengkap dengan isi didalamnya. Sebelum melangkah kepada konten rumus kimia dasar sma ada baiknya kita tengok dulu tentang rumus kimia dasar sma tersebut.
rumus kimia dasar sma memang sedang ramai dicari saat ini, Apalagi rumus kimia dasar sma yang akan saya share ini sangat penuh isi dengan informasi didalamnya. Saat ini banyak sekali teknologi yang super canggih, bisa dari Smartphone yang kalian punya sudah bisa melakukan apapun di tangan yang kamu pegang tersebut. Baik itu mencari kue,resep,keagamaan semuanya ada di Smartphone kalian.
Konten kali ini juga merupakan bagian dari pembahasan yang sudah banyak di dunia internet yang kalian pegang. Tentunya bahan yang akan aku bagikan sangat berbeda dari web sebelah yang lainnya, Sangat cetar membahana dan terpercaya.
Sepertinya tidak perlu panjang lebar lagi, langsung saja ke artikel utamanya Berikut informasi rumus kimia dasar sma lengkap dengan isinya.

Setelah mempelajari berbagai sifat kimia dasar yang meliputi konfigurasi elektron dan ikatan kimia, berikutnya kita melangkah menuju topik fundamental ilmu kimia lainnya, yakni perhitungan kimia. Perhitungan pada ilmu kimia pada umumnya bertujuan memperoleh nilai/kuantitas dari zat yang mengalami reaksi kimia, baik sebelum maupun sesudah reaksi.
Mengapa kita perlu mempelajarinya? Pada skala industri, tentu kita perlu memastikan bahwa reaksi yang kita lakukan untuk menghasilkan produk/komoditas berjalan dengan efektif bukan? Seandainya kita hanya membutuhkan 10 gram natrium hidroksida untuk membuat 1 gram sabun, namun karena kita tidak melakukan perhitungan terlebih dahulu, kita masukkan 100 gram natrium hidroksida dan tetap dihasilkan hanya 1 gram sabun, maka kita membuang pereaksi sebanyak 90 gram, yang tidak hanya buruk secara ekonomis namun juga akan menjadi limbah yang dapat mengotori lingkungan kita.
Pada awalnya, perhitungan kimia pada zaman sebelum modern (sebelum abad ke-20) didasarkan pada hukum-hukum yang dirumuskan ahli kimia zaman dahulu. Hukum-hukum ini disebut juga sebagai hukum dasar kimia, meliputi Hukum Lavoisier, Proust, Dalton, Gay-Lussac dan Avogadro, yang masih menjadi dasar perhitungan kimia yang kita lakukan hingga saat ini.

Dengan mempelajari hukum-hukum dasar ini kita juga dapat mempelajari perkembangan ilmu kimia dari masa lalu, bagaimana para ahli kimia dapat melakukan perhitungan dengan ketepatan yang tinggi meskipun tidak ‘dipersenjatai’ oleh instrumen/ alat pengukuran yang canggih dan mutakhir.
Setelah kemajuan pesat ilmu kimia pada abad ke-20 dan ditemukannya instrumen canggih maka para limuwan dapat memetakan massa berbagai atom dan membuat standarisasi untuk perhitungan kimia. Sebuah satuan jumlah untuk atom dan molekul diperkenalkan, yaknimolyang didasarkan pada massa relatif atom, dengan referensi standar pada massa isotop karbon-12.
PERUBAHAN MATERI 1. PERUBAHAN FISIKA ► Tidak terjadi perubahan permanen pada susunan zat dan jenis zat, yang berubah hanya sifat fisiknya saja. 2. PERUBAHAN KIMIA ► Terjadi perubahan sifat : ada endapan, suhu berubah, ada gelembung gas, warna berubah. ► Terjadi perubahan susunan zat. ► Terbentuk zat baru dengan sifat yang sama sekali berbeda dengan sifat zat asalnya (perubahan sifat permanen).

Bilangan yang menentukan letak keberadaan elektron suatu atom. a. Bilangan kuantum utama ( n ) menyatakan nomor kulit tempat terdapatnya elektron, jenisnya : K ( n = 1 ), L ( n = 2 ), M ( n = 3 ), N ( n = 4 ), dst. b. Bilangan kuantum azimuth ( ℓ ) menyatakan sub kulit tempat terdapatnya elektron, jenisnya : s = sharp nilai ℓ = 0 d = diffuse nilai ℓ = 2 p = principal nilai ℓ = 1 f = fundamental nilai ℓ = 3 Î Î
ℓ = 0 ( sharp ) ℓ = 0 ( sharp ) ℓ = 1 ( principal ) Î ℓ = 0 ( sharp ) Untuk n = 3 ℓ = 1 ( principal ) ℓ = 2 ( diffuse ) Î ℓ = 0 ( sharp ) Untuk n = 4 ℓ = 1 ( principal ) ℓ = 2 ( diffuse ) ℓ = 3 ( fundamental ) c. Bilangan kuantum magnetik ( m ) menyatakan orbital tempat terdapatnya elektron, jenisnya : Î m=0 Untuk ℓ = 0 Î m = –1 Untuk ℓ = 1 m=0 m = +1 Î m = –2 Untuk ℓ = 2 m = –1 m=0 m = +1 m = +2 Untuk n = 1 Untuk n = 2
MENENTUKAN LETAK ELEKTRON Untuk menentukan letak elektron maka perlu mengikuti aturan-aturan tertentu yang sudah ditetapkan. Aturan Aufbau : Elektron-elektron mengisi orbital dari tingkat energi terendah baru tingkat energi yang lebih tinggi Aturan Hund : Elektron-elektron tidak membentuk pasangan elektron sebelum masingmasing orbital terisi sebuah elektron Larangan Pauli : Tidak diperbolehkan di dalam atom terdapat elektron yang mempunyai keempat bilangan kuantum yang sama




















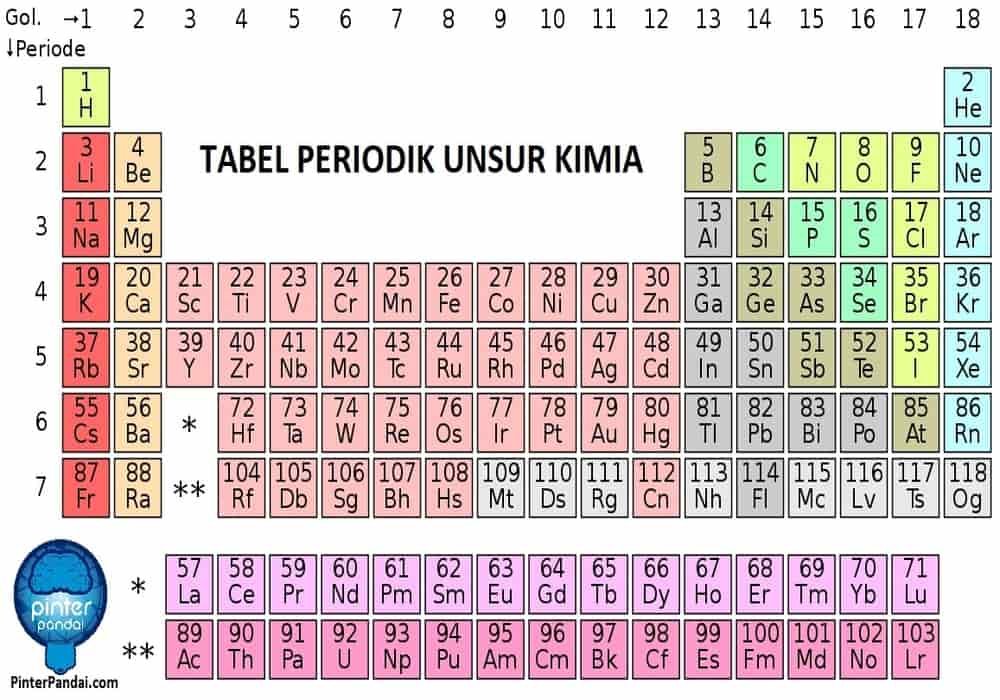







































































Gimana?, mantap bukan artikelnya?. Jikalau kamu ada pertanyaan soal rumus kimia dasar sma lebih dalam lagi, netizen bisa kasih solusi di kolom komentar untuk memperbaiki lagi website saya ini yang baru tahap pemula. Saya harap dengan adanya konten rumus kimia dasar sma ini, para abang dan nyonya permasalahannya bisa terselesaikan dan terhibur berkat adanya tulisan ini.
Sekian dari aku, Semoga artikel tentang rumus kimia dasar sma tersebut bisa bermanfaat bagi agan semuanya. Ending kata. See a untuk semuanya.
Posting Komentar untuk "rumus kimia dasar sma"